Wykupienie dostępu pozwoli Ci czytać artykuły wysokiej jakości i wspierać niezależne dziennikarstwo w wymagających dla wydawców czasach. Rośnij z nami! Pełna oferta →
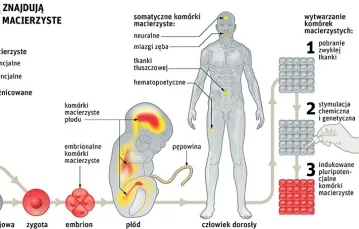
Każdego dnia w szpiku kostnym powstaje 100 miliardów nowych komórek krwi, mniej więcej tyle samo buduje naszą skórę. Ciało człowieka składa się z 80 organów zbudowanych z 10 bilionów komórek, które można podzielić na około 200 rodzajów. To wszystko powstaje z jednej komórki jajowej, do której kiedyś wniknął jeden plemnik. Komórka ta, zwana zygotą, dzieli się, i jeśli wszystko pójdzie zgodnie z genetycznym planem, na świecie pojawi się wkrótce kolejny organizm złożony z 10 bilionów komórek.
Komórki zmieniają swoje funkcje i specjalizują się, najczęściej aż do swojej ściśle zaprogramowanej komórkowej śmierci wykonując określone zadania. Za powstanie organizmu i jego ciągłą odbudowę odpowiadają komórki macierzyste. Po angielsku zostały nazwane znacznie bardziej obrazowo: stemcells, czyli komórki pnia.
Pień z konarami
Po raz pierwszy termin stem cell, a właściwie w niemieckiej formie Stammzelle, pojawił się w literaturze naukowej w 1868 r. Pracujący wówczas na Uniwersytecie w Jenie Ernst Haeckel był biologiem, zafascynowanym niedawno ogłoszoną teorią ewolucji. Jak wielu ówczesnych naukowców zajmujących się anatomią porównawczą i pochodzeniem gatunków, pracował nad własną klasyfikacją istot żywych. Tworzył drzewa rodowe zwane Stammbaume, w których wykazywał pochodzenie współczesnych organizmów od wspólnych przodków. W jednej z tych prac pojawia się termin Stammzelle, oznaczający początkowo jednokomórkowy organizm, z którego powstały wszystkie chodzące, pływające i latające istoty na Ziemi. Haeckel był przekonany, że poszczególne etapy ewolucyjnej historii gatunków (filogenezy) odtwarzane są także w życiu osobniczym organizmów (ontogenezie) – głosiła to tzw. teoria rekapitulacji. W 1877 r. użył słowa Stammzelle w nowym znaczeniu, bliższym współczesnej definicji komórki macierzystej – nazwał tak zapłodnioną komórkę jajową, z której rozwija się organizm z całym bogactwem rozmaitych, wyspecjalizowanych komórek.
Jeśli wyobrazić sobie procesy podziałów komórkowych i różnicowania w postaci drzewa, komórki macierzyste stanowią gruby pień, od którego odchodzą coraz mniejsze gałązki – coraz bardziej wyspecjalizowane komórki. Przy czym poszczególne klasy komórek macierzystych różnią się pod kątem tego, ile rodzajów „gałązek” może z nich wyrosnąć. Lepiej więc myśleć o nich nie jako o samym pniu, ale także o jego najgrubszych konarach.
Kasper Kalinowski: W zależności od wieku, kultury, nastroju czy stanu zdrowia możemy różnie postrzegać mijające godziny, dni i lata.
Z definicji komórki macierzyste spełniać muszą dwa kryteria. Muszą być zdolne do nieograniczonych podziałów i odnawiania populacji, a także muszą mieć możliwość różnicowania się w komórki budujące tkanki i spełniające określone funkcje w organizmie. Innymi słowy, komórka macierzysta musi podzielić się na taką, która dalej będzie macierzystą, i taką, która – pod wpływem aktywacji określonych genów i sygnałów z otoczenia – przekształci się w komórkę skóry, mięśnia, mózgu itp. Większość zwyczajnych, wyspecjalizowanych komórek ciała także potrafi się dzielić, ale tylko na taki sam typ komórek i tylko skończoną liczbę razy. Komórki macierzyste są pozbawione tych ograniczeń.
Ze względu na ich potencjał różnicowania się, wyróżnia się kilka klas komórek macierzystych. Istnieją komórki: toti-, pluri-, multi- i unipotencjalne.
Komórkami o największym potencjale (najbardziej uniwersalnymi) są komórki totipotencjalne. Powstają z nich wszystkie typy komórek, w tym łożysko, niezbędne w rozwoju płodowym. Komórkami totipotencjalnymi są zygota i komórki budujące zarodek, aż do piątego dnia ciąży, kiedy powstaje blastocysta, złożona z tzw. trofoblastu (prekursor łożyska) i skupiska pluripotencjalnych komórek macierzystych. Z nich również może powstać każda komórka organizmu, ale już nie łożysko.
Komórka multipotencjalna jest prekursorem różnych typów komórek, ale wyłącznie w obrębie danej tkanki. Najmniejszą zdolność różnicowania się ma komórka unipotencjalna. Jest to tzw. komórka prekursorowa (blast), powstaje z niej tylko jeden rodzaj komórek, np. hepatoblast przekształca się w hepatocyt, budujący wątrobę.
Ze względu na pochodzenie komórki macierzyste można podzielić na dorosłe (somatyczne), które są multi- lub unipotencjalne, oraz toti- lub pluripotencjalne zarodkowe komórki macierzyste. Te pierwsze można znaleźć w wielu miejscach organizmu, gdzie odpowiadają za jego ciągłą odbudowę. W kryptach jelitowych odtwarzają nabłonek, który jest bez przerwy złuszczany przez masy pokarmowe, w warstwie podstawowej naskórka odtwarzają naskórek i warstwę rogową, w szpiku kostnym – krwinki itd.
Każde życie z jaja
O ile pierwsze użycie terminu Stammzelle można określić na osi czasu i wskazać jednoznacznie na jego twórcę, o tyle przyznanie zaszczytu odkrywcy komórek macierzystych nie jest takie proste. Pojęcie komórki macierzystej, jak już się przekonaliśmy, jest bardzo pojemne.
O rozwoju zarodkowym wiedzieli już starożytni Grecy. Arystoteles prowadził przecież badania nad embriologią zwierząt i tworzył teorie dziedziczenia. Prace nad komórką jajową i zygotą trwały w Europie od dawna. William Harvey, XVII-wieczny angielski lekarz, stworzył zasadę ex ovo omne vivum. Twierdził, że każde, w tym „ssacze” życie pochodzi z jaja. Komórkę jajową u ssaka jako pierwszy odkrył Niemiec Karl Ernst von Baer w 1827 r. Natomiast ludzka komórka jajowa została opisana już po drugiej stronie Atlantyku przez odkrywcę estrogenów, Edgara Allena, w 1928 r. Przełomowym badaniom nad zygotami poświęcili się uczniowie Ernsta Haeckla, bracia Oskar i Richard Hertwigowie. Komórki prekursorowe krwi (czyli komórki macierzyste o stosunkowo niewielkim potencjale różnicowania się) zidentyfikowane zostały przez Ernesta McCullocha i Jamesa Tilla u myszy w połowie XX w. Ci sami badacze popchnęli naprzód przeszczepy szpiku.
Ks. Michał Heller: Pewnego świętego zapytano: co byś zrobił, gdyby ci powiedzieli, że za dwie godziny będzie koniec świata? Odparł: dalej grałbym w szachy. To bardzo mądra odpowiedź.
Embrionalne komórki macierzyste myszy wyizolowano po raz pierwszy w 1981 r. Po mysich embrionach przyszła pora na ludzkie. W 1996 r. embriolog z Wisconsin James Thompson zebrał 36 ludzkich zarodków pozostałych po procedurze zapłodnienia in vitro i z 14 z nich udało mu się wyizolować komórki macierzyste. Osadzone w idealnych do rozwoju warunkach inkubatora wytworzyły kolonie. Następnie Thompson umieścił w mysich macicach pojedyncze ludzkie komórki macierzyste, z których powstały trzy listki zarodkowe, czyli komórki prekursorowe dla skóry, kości, krwi, mózgu, mięśni i wszystkich innych tkanek.
Badania nad zarodkowymi komórkami macierzystymi, czyli tymi o największym potencjale różnicowania się, otwierają drogę do wielu terapeutycznych zastosowań, ale wywołują etyczne kontrowersje. Od niedawna znana jest jednak metoda, która pozwala całkowicie zrezygnować z wykorzystywania zarodków.
W 2006 r. japoński lekarz Shinya Yamanaka (nagroda Nobla w 2012 r.) opublikował w „Nature” pracę opisującą niezwykłe osiągnięcie – przekształcenie mysiej dorosłej komórki w komórkę macierzystą o podobnym potencjale co komórka zarodkowa. To trochę tak, jakby z jajecznicy, jajka ugotowanego na twardo albo omletu uzyskać z powrotem świeże jajko – z którego można przyrządzić dowolną jajeczną potrawę. Yamanace udało się znaleźć sposób, by tak posterować uaktywnianiem się konkretnych genów, by dorosłe, wyspecjalizowane komórki cofnąć w rozwoju.
W tym przypadku były to pobrane ze skóry myszy fibroblasty, które w normalnych warunkach przez resztę swojego komórkowego życia produkowałyby kolagen (białko zapewniające m.in. elastyczność ścięgien i skóry), nie mając żadnych szans, by zostać jakąś inną komórką organizmu.
Po czasie te wyspecjalizowane komórki cofały się w rozwoju do komórek macierzystych, mogących przekształcić się w dowolny rodzaj komórek organizmu. Przeprogramowane w ten sposób komórki macierzyste zaczęto nazywać „indukowanymi”. Rok później dwa zespoły, amerykański Thompsona i japoński Yamanaki, stworzyły ludzkie indukowane pluripotencjalne komórki macierzyste (iPSC) z fibroblastów.
Metoda nie okazała się ani przesadnie droga, ani skomplikowana. Naukowcy na całym świecie wkrótce zaczęli ją udoskonalać sprawdzając, które dojrzałe komórki można przekształcić w iPSC, czym iPSC różnią się od embrionalnych komórek macierzystych i w jakie komórki można je zróżnicować. Komórki macierzyste indukowano m.in. z keratynocytów, czyli komórek naskórka, hepatocytów występujących w wątrobie, limfocytów T pobranych z krwi obwodowej, a nawet z nerkowych komórek nabłonkowych uzyskanych z próbki moczu. Okazało się też, że iPSC nie różnią się praktycznie niczym od embrionalnych komórek macierzystych. Wyglądały tak samo pod mikroskopem. Produkowały te same białka i identyczne markery na swojej powierzchni. Tak samo mogły dzielić się w nieskończoność.
Cudowne terapie
Te wszystkie odkrycia, dokładne poznanie procesów różnicowania się komórek i ich przekształcania w komórki wysoko wyspecjalizowane, a także coraz większe możliwości edycji genów – to inna wielka rewolucja naukowa ostatnich lat – rozbudziły ogromne nadzieje. W dalekiej przyszłości można wyobrazić sobie w zasadzie wszystko. Hodowlę narządów do przeszczepu w szalkach, wypełnianie martwic po zawale serca komórkami macierzystymi, odbudowę mózgu po udarze, regenerację zwyrodniałych stawów i przerwanego rdzenia kręgowego. Niczym nieograniczona możliwość naprawy własnego ciała, wymiany zepsutych części, załatania rozmaitych dziur. Przedłużania życia (w nieskończoność?).
W dzisiejszych czasach najważniejsza okazała się odbudowa szpiku kostnego u chorych na nowotwory krwi. Tacy pacjenci po bardzo intensywnej chemio- i radioterapii są niemal całkowicie pozbawieni własnego szpiku, a w efekcie – odporności na infekcje.
Co ciekawe, pierwsze próby terapeutycznego wykorzystania szpiku (i zawartych w nim komórek macierzystych, o czym jeszcze nie wiedziano) podejmowano na początku ubiegłego wieku. Szpik pobrany od zdrowych pacjentów był jednak podawany doustnie, przez co jego efekt terapeutyczny można porównać do podania szpiku wołowego na toście z warzywami albo porcji kaszanki. Pierwszy udany przeszczep szpiku wykonano w 1956 r. w Nowym Jorku pomiędzy bliźniakami, z których jeden zachorował na białaczkę. Dwa lata później we Francji Georges Mathé przeprowadził pierwszy przeszczep szpiku pomiędzy niespokrewnionymi osobami. Wówczas po terapii u sześciu pracujących wcześniej przy reaktorze jądrowym Jugosłowian wystąpiła choroba „przeszczep przeciwko gospodarzowi”. Komórki układu odpornościowego zawarte w przeszczepionym szpiku zaatakowały organizm biorcy. To wszystko odbywało się bez pełnego zrozumienia ze strony lekarzy, czym właściwie są komórki macierzyste i jak działają.
JOSEPH LEDOUX, neurobiolog: U twoich stóp pojawia się wąż. Serce zaczyna bić szybko, zostają uwolnione hormony stresu, ale to jeszcze nie jest odczucie strachu. Ono wymaga uświadomienia sobie, że to wszystko się dzieje, a wąż zaraz cię ukąsi.
Dopiero odkrycia wspomnianych wcześniej Tilla i McCullocha, a także kolejne dokonania naukowców, takie jak znalezienie innych źródeł komórek macierzystych krwi, i to o większym potencjale różnicowania się, opracowanie metod izolowania komórek macierzystych i wykrycie białek sygnałowych kierujących ich rozwojem – pozwoliły na upowszechnienie terapii z wykorzystaniem tych komórek. Niebagatelny wkład w rozwój tej dziedziny medycyny miał zespół Irvinga Weissmana, obecnie dyrektora Instytutu Biologii Komórek Macierzystych i Medycyny Regeneracyjnej na Uniwersytecie Stanforda. Weissmanowi udało się nie tylko jako pierwszemu wyizolować ze szpiku (najpierw myszy, potem ludzi) komórki macierzyste produkujące różne krwinki – w tym komórki układu odpornościowego – ale także drobiazgowo opisać poszczególne stadia ich rozwoju.
Komórki macierzyste krwi poza szpikiem obecne są we krwi pępowinowej, a nawet we krwi obwodowej dorosłych osób. Odpowiednio pozyskane od dawcy (którym może być sam pacjent), poddane pewnym procesom i zaaplikowane choremu – potrafią w dość złożonym procesie zagnieździć się w niszy szpiku kostnego (w jamach szpikowych w kościach) i podjąć funkcję krwiotwórczą. Pacjent pozbawiony narządu, po przeszczepie komórek macierzystych znów go posiada.
Po sukcesach w dziedzinie regeneracji szpiku kostnego i komórek krwi celem wielu naukowców stała się odbudowa uszkodzonych organów. Podjęto prace nad regeneracją właściwie wszystkich układów. Ten boom na medycynę regeneracyjną zaowocował wieloma istotnymi odkryciami.
W 2015 r. Komisja Europejska dopuściła do sprzedaży preparat Holoclar, w którym znajdują się komórki macierzyste rąbka rogówki. Ze zdrowego oka pacjenta pobiera się fragment rąbka, a zawarte w nim komórki macierzyste (unipotencjalne) namnaża i osadza na specjalnej membranie uformowanej w kształt nowej rogówki. Po usunięciu zniszczonej rogówki wszczepia się tę wyhodowaną.
Inny kierunek badań wyznaczają próby pobudzenia dorosłych komórek macierzystych do podziałów i różnicowania. Sukcesem, na razie na niewielką, eksperymentalną skalę, staje się wykorzystanie komórek macierzystych w leczeniu oparzeń. Prowadzone są też badania nad połączeniem przerwanego rdzenia kręgowego za pomocą takich komórek.
Podobnych terapii jest znacznie więcej. Od 2018 r. w bazie PubMed pojawiło się ponad 66 tys. nowych artykułów naukowych na temat komórek macierzystych, a łącznie można ich tam znaleźć prawie 360 tys. Próby stosowania tych terapii podejmowane są we wszystkich medycznych specjalizacjach od neurologii po ortopedię.
Złudne nadzieje?
Według wyszukiwarki clinicaltrials.gov obecnie na całym świecie prowadzonych jest ponad 6 tys. badań klinicznych nad komórkami macierzystymi, ich efektywnością i skutkami. W tym twórczym chaosie, jak to często bywa, pojawiają się także metody pseudonaukowe. Wykorzystując nadzieję związaną z medycyną regeneracyjną, próbuje się sprzedać metody niesprawdzone i nieskuteczne, a czasem groźne. W amerykańskiej prasie co jakiś czas przeczytać można informacje o nieudanych, „eksperymentalnych” terapiach komórkami macierzystymi. Jedna z głośniejszych spraw została opisana w 2017 r. przez medyczne czasopismo „New England Journal of Medicine”.
Trzy starsze kobiety zgłosiły się do jednej z klinik, by wziąć udział w próbie terapii zwyrodnienia plamki żółtej za pomocą komórek macierzystych. Już od początku ten „eksperyment” mógł budzić podejrzenia, ponieważ przed leczeniem pacjentki miały wpłacić po 5 tys. dolarów na konto kliniki. Poważne i wiarygodne ośrodki naukowe nigdy nie pobierają opłat za zgłoszenie się do badań klinicznych.
U chorych okulistycznie kobiet wykonano odsysanie niewielkiej ilości tkanki tłuszczowej, by z niej wyizolować komórki macierzyste. Następnie wszczepiono te komórki do obu oczu jednocześnie, co również nie jest typową praktyką w badaniach klinicznych. Wkrótce kobiety straciły wzrok, bowiem taki zabieg wiąże się z niebezpiecznymi komplikacjami: odklejenie siatkówki, krwotoki do gałki ocznej itd.
Komórki macierzyste w pewnym sensie podzieliły los witamin C lub D3. Niektórzy, ignorując wyśrubowane standardy badań klinicznych, próbują leczyć nimi wszystko, od autyzmu po zaburzenia erekcji. W USA w drugiej dekadzie XXI w. powstało mnóstwo klinik oferujących właśnie takie leczenie: w 2009 r. były dwie, a już w 2018 r. działało ich ponad 700. Najwięcej na Florydzie i w Kalifornii, gdzie często przenoszą się bogaci emeryci. Są łatwym łupem dla ośrodków oferujących wieczną młodość i długie życie bez nieuleczalnych chorób.
Coraz częściej także w Polsce pojawiają się kliniki na modłę zachodnią, oferujące za 2 tys. zł wygładzenie pomarszczonej twarzy dzięki komórkom macierzystym uzyskanym z krwi. Z kolei komórki pobrane z tłuszczu wyleczą stawy za 12 tys. Strony internetowe obiecują cuda, choć nie podają wielu faktów.
Profesor Andrzej Szczeklik, który jak nikt inny potrafił łączyć nowoczesną medycynę z humanistycznym i filozoficznym spojrzeniem, mówiąc o medycynie regeneracyjnej przytoczył kiedyś mit o Sybilli Kumańskiej. Apollo próbował uwieść Sybillę i obiecał, że spełni jej dowolne życzenie. Sybilla poprosiła o długie, tysiącletnie życie. Bóg spełnił jej życzenie, ale nie otrzymał w zamian jej serca. Sybillę spotkał gniew Apolla. A ponieważ nie poprosiła o wieczną młodość, starzała się w nieskończoność. Błagała Apolla o śmierć, ale obrażony bóg pozostał niewzruszony.
Komórki macierzyste uchyliły przed człowiekiem drzwi do wiecznego życia w zdrowiu, dały szansę na stanie się Sybillą Kumańską XXI w. – tysiącletnią i zawsze młodą. Problem w tym, że może być to droga złudna, a drzwi wciąż są tylko uchylone. ©

IRVING WEISSMAN kieruje Instytutem Biologii Komórek Macierzystych i Medycyny Regeneracyjnej na Uniwersytecie Stanforda. Jest jednym z najbardziej wpływowych badaczy komórek macierzystych, zwłaszcza tych występujących w szpiku oraz tych związanych z powstawaniem nowotworów. Jego badania cytowane były ponad 192 tys. razy. Laureat wielu prestiżowych wyróżnień, m.in. nagrody Roberta Kocha (2008 r.). Prof. Weissman jest jedną z gwiazd tegorocznej edycji Copernicus Festival.
Pierwsza wersja tekstu ukazała się w „TP” 5/2019
NOWOTWORY
Poza somatycznymi komórkami macierzystymi, które odnawiają ludzkie tkanki, i embrionalnymi – budującymi zarodki – istnieją również nowotworowe komórki macierzyste. Termin ten zaproponowany w 2001 r. przez profesora Irvinga Weissmana (z angielskiego Cancer Stem Cells – CSC) określa grupę komórek w masie nowotworowej, którą cechują właściwości nieco odmienne od reszty komórek rakowych. Po raz pierwszy CSC odkryto w 1994 r. wśród komórek białaczkowych. Później znaleziono je także w guzach litych, takich jak rak jelita grubego, trzustki czy piersi. Uważa się, że to CSC odpowiadają za wznowy miejscowe i przerzuty, które są ogromnym problemem w terapii onkologicznej. Komórki te bywają oporne na działanie chemioterapii i zdolne są do tworzenia przerzutów w miejscach odległych od pierwotnego guza, czego dowodzą badania na zwierzętach. Jeśli przeszczepić CSC myszom z upośledzoną odpornością, rozwija się nowotwór. To odróżnia je od zwykłych komórek rakowych, które choć potrafią się dzielić (i nie chcą poddać się procesom zaprogramowanej śmierci komórkowej), nie są w stanie stworzyć w nowych warunkach guza. ©