Wykupienie dostępu pozwoli Ci czytać artykuły wysokiej jakości i wspierać niezależne dziennikarstwo w wymagających dla wydawców czasach. Rośnij z nami! Pełna oferta →
Ostatnie lata w świecie biologii molekularnej należą do technologii edytowania genów metodą CRISPR-Cas9. Wielu naukowców nazywa ten okres rewolucją. Porównują ją z przełomem z lat 80. XX wieku, kiedy poznano metodę namnażania DNA w probówce. Lawinowo rośnie liczba publikacji wykorzystujących technikę CRISPR-Cas9 albo wprowadzających do niej ulepszenia. Dziesiątki naukowców dyskutują jej możliwe zastosowania. Skąd ten szum?
CZYTAJ TAKŻE:
Artur Sporniak: Za symboliczny początek narodzin terapii genowej można uznać rok 1990, w którym rozpoczęto leczenie czteroletniej Ashanthy DeSilvy chorej na ciężki złożony niedobór odporności (jedną z wielu genetycznych chorób).
Miejsce w genomie
Naukowcy od lat marzyli o precyzyjnym narzędziu, dzięki któremu będą mogli badać funkcje poszczególnych genów w ludzkich komórkach. Takie zabiegi od dawna były możliwe w drożdżach, co uczyniło z nich bardzo popularny organizm modelowy. Jednak medycyna potrzebowała narzędzia, które pozwoliłoby na podobne zabiegi w komórkach ludzkich. Taka technologia zaczęła się rozwijać za sprawą prac prowadzonych w laboratorium prof. Jennifer Doudna na Uniwersytecie Kalifornijskim w Berkeley (USA). Wyniki prac nad metodą nazwaną CRISPR-Cas9 opublikowano w 2012 r.
W artykule, który ukazał się w bożonarodzeniowym wydaniu tygodnika „Nature”, prof. Doudna przyznaje, że właśnie w 2012 r. zaczęły się też jej problemy ze snem.
Technologia edycji genów lotem błyskawicy rozpowszechniła się na całym świecie. Naukowcy wykorzystywali ją do modyfikacji komórek wszelkich możliwych organizmów. Sama prof. Doudna, opierając się na prywatnych statystykach, przyznaje, że wyśledziła prace na trzech tuzinach różnych organizmów.
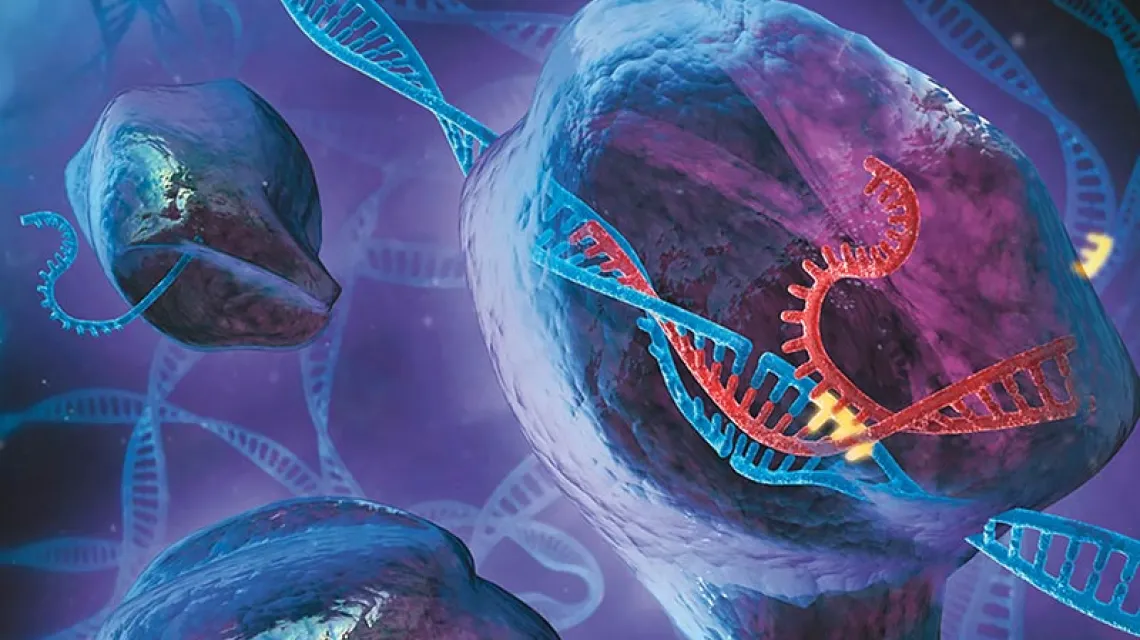
Opisywane skrótem CRISPR (z ang. Clustered Regularly Interspaced Short Palindromic Repeats) sekwencje DNA to ściśle określone miejsca w genomie bakterii. Są one częścią unikalnego bakteryjnego systemu odpornościowego, wykorzystywanego przeciwko atakom wirusów. Bakteriofagi, czyli wirusy atakujące bakterie, przyczepiają się do komórki bakteryjnej i tworzą z nią specjalne połączenie, przez które „wstrzykują” swoje DNA do wnętrza i zmuszają bakterię do produkcji nowych cząstek wirusa. Ale też bakteria „zapamiętuje” te fragmenty DNA, przechowując ich elementy właśnie w miejscach CRISPR swojego genomu. Jeśli nastąpi kolejna infekcja tym samym rodzajem wirusa, bakteria może się przed nim bronić, wykorzystując właśnie te zapamiętane fragmenty DNA oraz specjalny enzym – Cas9, który tnie materiał genetyczny wirusa, uniemożliwiając mu namnażanie.
Sekwencje CRISPR odkryto u bakterii w roku 1987, ale dopiero 20 lat później naukowcy powiązali je z bakteryjnym systemem odpornościowym, a w pamiętnym 2012 r. pokazali, jak można wykorzystywać ten mechanizm do edycji genów. Najprościej rzecz ujmując, metoda kryjąca się pod skrótem CRISPR-Cas9 to takie „wytnij-wklej” do sekwencji DNA. Składają się na nią sekwencja przewodnia (z ang. Guide), nożyczki, czyli enzym Cas9, oraz sekwencja DNA, którą chcemy wkleić do genomu. Guide wskazuje konkretne miejsce, w którym należy przeciąć DNA. Cas9 dokonuje odpowiedniego nacięcia, w które następnie wbudowany jest nowy fragment.
Nadzieje i obawy
Gdy biolodzy molekularni chcą zbadać funkcję konkretnych genów, często uciekają się do ich „wyłączenia”, żeby następnie obserwować, jakie niesie ono skutki dla komórki. Metody, które dotychczas wykorzystywano do „wyłączania” genów, były przede wszystkim skomplikowane i drogie. Niosły też szereg efektów ubocznych, które trudno było kontrolować nawet w warunkach laboratoryjnych. Wreszcie, wymagały specjalistycznego i drogiego sprzętu. Tymczasem system CRISPR-Cas9 jest bardzo tani, konieczne odczynniki można kupić za kilkadziesiąt dolarów od jednej z wielu oferujących je firm biotechnologicznych, a do pracy wystarczy podstawowo wyposażone laboratorium, zbudowane nawet w garażu.
Ponadto CRISPR daje możliwość wprowadzenia trwałej zmiany genetycznej we wszystkich komórkach zwierzęcia i obserwacji skutków takiej ingerencji na przestrzeni jego życia. Stwarza to potencjał do rozwijania terapii genowych celowanych w konkretny rodzaj mutacji. Istnieje wiele chorób metabolicznych, w których naprawa pojedynczej mutacji całkowicie uleczyłaby pacjenta.
W 2014 r. naukowcy z Massachusetts Institute of Technology opisali, jak wykorzystali edycję genów u myszy do naprawy mutacji powiązanej z ludzką chorobą metaboliczną – tyrozynemią. Był to pierwszy krok pokazujący, że technika może doprowadzić do powrotu do prac nad terapią genową u ludzi. Zdaniem prof. Doudna przyszłe postępy w medycynie związane z techniką CRISPR-Cas9 mogą całkowicie wyeliminować tak ciężkie choroby jak dystrofia mięśniowa, mukowiscydoza czy anemia sierpowata.
Na razie jednak takie rozważania ograniczają się do teorii – ze względu na aspekty bioetyczne, a także dlatego, że naukowcy muszą nabrać absolutnej pewności, iż „nożyczki” Cas9 nie wymykają się spod kontroli i nie tną DNA w niepożądanych miejscach. Bo co z tego, że naprawimy jedną mutację, jeżeli zupełnie nieświadomie możemy wprowadzić nową w innym miejscu genomu?
Człowiek GMO?
Wraz z lawinowo rosnącą liczbą publikacji w biomedycznej bazie PubMed prof. Doudna spała jednak coraz gorzej. W bezsenne noce zastanawiała się, kiedy technologię edycji genomu ktoś wykorzysta na ludziach.
W kwietniu 2015 r. na łamach naukowego pisma „Protein & Cell” ukazała się praca chińskiego zespołu naukowców, którzy wykorzystali CRISPR-Cas9 do edycji DNA w ludzkim embrionie. Jak przyznał sam szef grupy badaczy, Junjiu Huang, ich artykuł odrzuciły wcześniej prestiżowe „Nature” i „Science”, kierując się względami etycznymi.
To wydarzenie postawiło kropkę nad „i”. Choć prof. Doudna nie chciała się początkowo angażować w rozważenia bioetyczne, to teraz musiała zabrać głos. Przez cały ubiegły rok wypowiadała się na ponad 60 spotkaniach organizowanych w szkołach, uniwersytetach, firmach oraz na niezliczonych konferencjach naukowych na całym świecie.
W grudniu 2015 r. w Waszyngtonie odbył się szczyt na temat edycji genów u ludzi. Wzięli w nim udział naukowcy amerykańscy, brytyjscy i chińscy. Stanowisko szczytu jest jasne: technologii edycji genomu nie powinno się wykorzystywać na ludzkich embrionach, z których mogłyby się urodzić dzieci. Nie wiadomo jednak, na ile powstrzyma to niektórych nieprzewidywalnych naukowców.
Debata w środowisku naukowym rozgorzała na dobre. Dla jednych edycja genów pozwoli eliminować groźne choroby genetyczne, zanim dziecko się urodzi. Inni alarmują, że to niebezpieczne – choćby dlatego, że takie zmiany podlegają dziedziczeniu – i nieetyczne. Bo jak po równi pochyłej prowadzi ku tworzeniu genetycznie modyfikowanych ludzi.
Najnowszy akord debaty wybrzmiał kilka dni temu w Wielkiej Brytanii. 1 lutego tamtejsza Komisja ds. Płodności Człowieka i Embriologii zgodziła się, żeby naukowcy z Instytutu Francisa Cricka przeprowadzili metodą CRISPR-Cas9 badania nad ludzkim embrionem. Chodzi o zbadanie, które dokładnie geny odpowiadają za rozwój zarodka – właśnie poprzez wyłączanie kolejnych i sprawdzanie, co to zmieni – żeby odkryć przyczyny poronień i usprawnić procedurę in vitro.
To pierwsza w Europie zgoda na tak kontrowersyjne badania.
Prof. Doudna dostaje listy od pacjentów ze zidentyfikowanymi mutacjami. Pytają, czy są już szanse na ich wyleczenie. Na łamach „Nature” badaczka wspomniała o młodej kobiecie z mutacją w genie BRCA1, co daje jej 60 proc. ryzyka zachorowania na raka piersi przed 70. rokiem życia. Dziewczyna zastanawiała się, czy wzorem Angeliny Jolie poddać się operacji usunięcia piersi i jajników, czy może CRISPR-Cas9 jest dla niej szansą i powinna się wstrzymać.
Dziś nauka nie potrafi jej jeszcze odpowiedzieć. ©
Korzystałam z: Jennifer Doudna, „Genome-editing revolution: My whirlwind year with CRISPR”, „Nature”, 22 grudnia 2015 r.; „CRISPR/Cas9 and Targeted Genome Editing: A New Era in Molecular Biology”, strona internetowa New England Biolabs; David Cyranoski, Sara Reardon, „Chinese scientists genetically modify human embryos”, www.nature.com.
Dr ANNA BARTOSIK jest biolożką i popularyzatorką nauki, studia doktoranckie odbyła w Europejskim Laboratorium Biologii Molekularnej w Heidelbergu. Stale współpracuje z „TP”.