Wykupienie dostępu pozwoli Ci czytać artykuły wysokiej jakości i wspierać niezależne dziennikarstwo w wymagających dla wydawców czasach. Rośnij z nami! Pełna oferta →
O wykorzystaniu mRNA w medycynie zrobiło się głośno za sprawą pandemii koronawirusa i szczepionek firm Pfizer i BioNTech oraz Moderna. Ale historia tej technologii zaczęła się kilka dekad wcześniej.
Jeden z przełomowych eksperymentów opisano w 2005 r. Amerykańska biochemiczka węgierskiego pochodzenia Katalin Karikó – obecnie wiceprezes firmy BioNTech i matka dwukrotnej złotej medalistki olimpijskiej w wioślarstwie, Susan Francii – po latach badań wraz ze swoimi współpracownikami odkryła, jak należy zmodyfikować kwas rybonukleinowy (RNA), by mógł przebić się przez zasieki układu odpornościowego i dostać do wnętrza komórek. Od tego czasu przeprowadzono już dziesiątki badań klinicznych z zastosowaniem tej technologii.
Szpetny, nieuchwytny zbój
Żeby wyjaśnić, na czym ta technologia polega, musimy się cofnąć do połowy XX w. W 1953 r. James Watson, Francis Crick, Maurice Wilkins i Rosalind Franklin opisują strukturę DNA – słynną podwójną helisę. Ważne miejsce zajmują w niej cztery zasady azotowe: adenina, guanina, cytozyna i tymina (zwyczajowo zapisywane w skrócie jako A, G, C i T). Już wcześniej wiedziano, że występujący w jądrze komórkowym DNA musi być nośnikiem informacji genetycznej – a więc kluczową cząsteczką organizmów żywych. Mimo przełomowego odkrycia Watsona i jego współpracowników nadal nie było jasne, w jaki sposób informacja genetyczna uporządkowana w dwuniciowym DNA przekładana jest na różnorodność form i funkcji białek – podstawowych elementów strukturalnych i funkcjonalnych każdej komórki (cały ten proces określa się mianem ekspresji genów).
Białka mogą przecież występować w postaci długich włókien w mięśniach i odpowiadać za ich skurcze (miozyna i aktyna), transportować tlen lub żelazo (hemoglobina i ferrytyna), wspomagać odporność (przeciwciała) czy przyspieszać i spowalniać reakcje chemiczne zachodzące w komórkach (laktaza, polimeraza DNA). Niemal wszystko, co robi żywy organizm, opiera się na produkcji i wykorzystaniu jakichś białek.
Od początku zakładano, że musi istnieć pośrednik pomiędzy DNA a białkami, jakaś „cząsteczka posłaniec”. Miało to sens – informacja genetyczna jest dla organizmu bardzo cenna, więc dostęp do DNA powinien być ograniczony. Watson podejrzewał, że „posłańcem” może być RNA, do czego próbował przekonać Cricka i innych naukowców. Powstał wtedy nawet klub dyskusyjny zainicjowany przez George’a Gamowa, fizyka rosyjskiego pochodzenia, który skupiał naukowców pragnących rozwikłać mechanizm syntezy białek. Było to nieoficjalne grono, nazywane Krawatowym Klubem RNA, którego członkowie dzielili się pomysłami i opiniami. Ich znakiem rozpoznawczym były zielone wełniane krawaty ze złotym haftem w kształcie łańcucha RNA.
Naukowcy nie tylko formułowali teorie, ale próbowali je także eksperymentalnie potwierdzać. Poza komórką trudno jednak było uchwycić proces syntezy białek, ponieważ w roztworach wodnych, w których nie ma wielu składników występujących naturalnie w komórkach, okazał się on niestabilny. Prowadziło to do frustracji i może właśnie dlatego Francis Crick pisał o cząsteczce RNA „ten szpetny, nieuchwytny zbój!”. Ewidentnie w próbówkach brakowało czegoś, co by spajało rybosomy – komórkowe fabryki białek – w trakcie ich syntezy.
Tym magicznym elementem – jak udowodnili Sydney Brenner i François Jacob – okazały się jony magnezu. Po dodaniu magnezu naukowcom udało się wyodrębnić „posłańca” i wykazać, że jest nim cząsteczka mRNA (od ang. messenger – posłaniec), wierna kopia DNA powstająca w procesie transkrypcji w jądrze komórkowym i wysyłana do wnętrza komórki, by stanowić tam doraźną matrycę do syntezy białek.
Dekady kolejnych badań naukowych pozwoliły lepiej zrozumieć skomplikowany proces ekspresji genów. Wykazano, że RNA występuje w komórkach w bardzo zróżnicowanej wielkości i strukturze oraz że pełni rozmaite funkcje. Najczęściej powstaje ono w jądrze w formie prekursorowej (pre-mRNA), w której skład wchodzą sekwencje kodujące, tzw. eksony, i sekwencje niekodujące, nazywane intronami. Dojrzewanie mRNA (ang. splicing) polega na precyzyjnym wycięciu intronów i połączeniu sekwencji kodujących. W ten skomplikowany proces zaangażowanych jest wiele małych cząsteczek RNA. Tak powstaje w pełni funkcjonalne mRNA.
Kod do złamania
Odkrycie „posłańca” to dopiero połowa sukcesu – trzeba było jeszcze ustalić, jak informacja zawarta w RNA jest rozszyfrowywana i przekształcana w białko. W dużej mierze sprowadzało się to do zagadnienia matematycznego, jak przy pomocy czterech typów „liter” budujących DNA (wspomnianych zasad azotowych): A, G, C i T – w mRNA przepisywanych na A, G, C oraz U – zakodować ułożenie 20 rodzajów aminokwasów, z których zbudowane są białka. W uproszczeniu chodzi o to, żeby przełożyć alfabet, w jakim zapisane są geny, na alfabet białek. Francis Crick i Sydney Brenner przeprowadzili serię pomysłowych eksperymentów, dzięki którym udowodnili, że taki kod jest „trójkowy”, czyli jednemu aminokwasowi odpowiadają dokładnie trzy litery DNA. Dalsze badania pozwoliły dopasować odpowiednie trójki do 20 aminokwasów, a także wykazać, że jest jedna „trójka”, AUG, która zawsze zaczyna cały proces, i trzy „trójki” stanowiące sygnał „stop”. Produkcja białek na podstawie informacji genetycznej zapisanej w mRNA angażuje kolejne rodzaje RNA: transferowy RNA (tRNA) i rybosomalny RNA (rRNA). Funkcja tRNA polega na dostarczeniu odpowiedniego aminokwasu w miejsce syntezy białka. I właśnie na tym etapie dochodzi do rozkodowania informacji genetycznej. Cały proces, nazywany translacją (tłumaczeniem), odbywa się w molekularnych maszynach – rybosomach, zbudowanych z białek i rRNA.
Dzięki tym badaniom naukowcy odczytali uniwersalny kod genetyczny (podzielany przez wszystkie organizmy żywe) i opisali przepływ informacji genetycznej z DNA przez RNA do białek, nazywany przez Francisa Cricka „centralnym dogmatem”. Wtedy, w połowie XX w., panowało przekonanie, że taki schemat jest uniwersalny w przyrodzie. Kolejne lata pokazały jednak, że są wyjątki. W 1970 r. David Baltimore i Howard Temin niezależnie od siebie odkryli enzym, który jest w stanie stworzyć kopię DNA na podstawie sekwencji zawartej w RNA. Ta tzw. odwrotna transkryptaza została wyizolowana z retrowirusów, czyli rodzaju wirusów, które (podobnie jak koronawirusy) swój materiał genetyczny przechowują w formie RNA, a nie tak jak my – w DNA. Odkrycie to wywróciło do góry nogami centralny dogmat Francisa Cricka, bo okazało się, że przepływ informacji genetycznej nie jest już uniwersalnie jednokierunkowy.
Odwrotna transkryptaza jest powszechnie stosowana w laboratoriach biologii molekularnej, zwłaszcza w badaniach ilości poszczególnych mRNA w komórkach. Jak wiemy chociażby na podstawie rygorystycznych wytycznych dotyczących przechowywania i transportu szczepionek Pfizer/BioNTech, mRNA jest bardzo nietrwałe i wrażliwe na zmiany temperatury. Dlatego naukowcom jest wygodniej zaraz po wyizolowaniu mRNA z komórek „przepisać” je przy użyciu wspomnianego enzymu na DNA – i taką stabilną kopię wykorzystywać do dalszych eksperymentów.
Ale to wcale nie koniec różnorodności świata RNA. Mnóstwo różnych rodzajów kwasów rybonukleinowych – m.in. snRNA czy snoRNA – wspomaga opisane powyżej procesy, a także samo powstawanie tRNA czy rRNA. Zapewne jest też wiele innych rodzajów kwasów rybonukleinowych, które dopiero czekają na odkrycie.
Jak wyciszyć gen
W tej dużej rodzinie szczególnie interesujące są stosunkowo niedawno poznane cząsteczki piRNA, występujące w męskich komórkach rozrodczych. Ważną rolę odgrywają małe niekodujące cząsteczki RNA – miRNA, które regulują procesy transkrypcji w jądrze komórkowym, mogą je wspomagać lub wyciszać. Na naturalnym zjawisku czasowego wyciszania genów w komórkach oparta jest opracowana przez naukowców technologia RNAi (z ang. RNA interference), wykorzystywana zarówno w badaniach laboratoryjnych, jak i w celach terapeutycznych.
Metoda ta polega na wiązaniu cząsteczki mRNA w komórkach za pomocą krótkich fragmentów siRNA (z ang. short interfering RNA) wprowadzanych z zewnątrz. Ponieważ sekwencja nukleotydowa mRNA jest unikalna, można tak zaprojektować krótki siRNA, żeby wiązał się z dokładnie wybranym mRNA.
Metoda została opracowana przez biologów Andrew Fire’a i Craiga C. Mella już ponad 20 lat temu w trakcie badań nad wyciszaniem genów u nicienia C. elegans, ale ich odkrycie spotkało się z dużym zainteresowaniem na początku XXI w., gdy zaczęto wykorzystywać tę technikę w badaniach podstawowych i w rozwijaniu terapii. W laboratoriach na całym świecie przez wiele lat technika RNAi była stosowana do analizowania funkcji poszczególnych białek poprzez obserwację efektu chwilowego wyciszenia kodujących je genów w komórkach. Dopiero rozwój i komercjalizacja metody CRISPR/Cas9, dzięki której można z chirurgiczną precyzją całkowicie wyłączyć dany gen w komórkach, ograniczyła stosowanie RNAi w badaniach podstawowych.
Technika RNAi może być ukierunkowana na konkretne białko, którego produkcja w komórkach powoduje występowanie choroby. Dlatego ma terapeutyczny potencjał w chorobach genetycznych czy nowotworach. Jednak mimo początkowego entuzjazmu środowiska naukowego, wyniki wielu wczesnych faz badań klinicznych rozczarowywały – ze względu na niską skuteczność i wysoką toksyczność. W konsekwencji większość dużych firm farmaceutycznych, takich jak Pfizer czy Merck, wycofała się ze swoich programów badawczych opartych na zastosowaniu techniki RNAi u ludzi. Głównym problemem okazało się dostarczenie siRNA do odpowiednich komórek i utrzymanie w nich wystarczającego stężenia do wywołania efektu terapeutycznego.
Ale firma Alnylam Pharmaceuticals, pomimo początkowych wyzwań technologicznych, kontynuowała badania i opracowała metodę transportu siRNA w krwi przy wykorzystaniu pewnego cukru, który wiąże się z receptorami na powierzchni komórek wątroby – i dzięki temu może dostarczać siRNA właśnie do tego organu. Badania te zaowocowały zatwierdzeniem pod koniec 2020 r. przez amerykańską Agencję Żywności i Leków (FDA) terapii stosowanej w leczeniu rzadkiej choroby genetycznej znanej jako pierwotna hiperoksaluria typu 1. Choroba ta powoduje nadprodukcję przez wątrobę szczawianów – związków, które mogą gromadzić się w nerkach i drogach moczowych, powodując szereg szkodliwych skutków dla organizmu. Do tej pory jedyną skuteczną terapią w przypadku tej choroby był przeszczep wątroby. Lumasiran jest pierwszym lekiem, który redukuje poziom szczawianów u pacjentów poprzez blokowanie mRNA, który koduje enzym zaangażowany w syntezę tych związków.
Lumasiran jest trzecią terapią opartą na RNAi rozwiniętą w laboratoriach Alnylam Pharmaceuticals i zatwierdzoną przez FDA. Wcześniej, w 2018 i 2019 r., zostały zatwierdzone terapie na dwie inne rzadkie choroby genetyczne. Patisiran to lek RNAi na dziedziczną amyloidozę transtyretyny, która powoduje gromadzenie się w układzie nerwowym białka transtyretyny. Drugi lek, givosiran, stosowany jest z kolei w ostrej porfirii wątrobowej, która prowadzi do nagromadzenia toksycznych cząsteczek polipiryny.
Wszystkie trzy leki są bardzo drogie, roczna kuracja lumasiranem dla jednej osoby kosztuje blisko pół miliona dolarów, a pacjenci będą prawdopodobnie musieli przyjmować lek przez całe życie, aby utrzymać niski poziom szczawianów. Kolejnym ważnym krokiem przed naukowcami jest opracowanie skutecznych metod, które pozwolą na dostarczenie terapii RNAi do innych organów niż wątroba. Prace takie prowadzi wiele laboratoriów, przy pomocy różnych nośników – takich jak przeciwciała czy cząstki lipidowe.
Szczepionką w nowotwór
Dopuszczenie do stosowania szczepionek przeciwko COVID-19 opartych na mRNA jest bardzo obiecujące nie tylko ze względu na powstrzymanie pandemii, ale także z punktu widzenia rozwoju przeciwnowotworowych szczepionek mRNA. Ich mechanizm działania polega na wprowadzeniu do komórek mRNA, w którym zakodowana jest informacja o białku antygenowym – swoistej metce, która informuje układ odpornościowy o tym, czy ma do czynienia ze „swoim” czy „obcym”.
Po dostarczeniu mRNA komórki same syntetyzują białka antygenowe w rybosomach, a następnie prezentują je na swojej powierzchni, wywołując lokalną odpowiedź układu odpornościowego, która skutkuje pamięcią immunologiczną i produkcją przeciwciał (skierowanych na konkretne antygeny). Szczepionki można zaprojektować tak, aby celowały w antygeny związane z nowotworem, które są obecne na powierzchni komórek rakowych. U pacjentów onkologicznych często układ immunologiczny jest oszukiwany przez substancje produkowane przez nowotwór – w efekcie nowotwór traktowany jest jak zdrowa tkanka. W takiej sytuacji szczepionka mRNA służyłaby do stymulacji układu odpornościowego w celu zwalczania komórek rakowych, co nie miałoby żadnego wpływu na zdrowe komórki.
Antygeny nowotworowe są bardzo spersonalizowane, ale szczepionki mRNA mogą być dostosowane do indywidualnych potrzeb pacjenta. Naukowcy rozważają też szczepionki nakierowane na czynniki wzrostu wspomagające namnażanie komórek rakowych. Podobnie jak w przypadku metody RNAi, głównym wyzwaniem technologicznym jest droga i forma podania mRNA, tak by terapia była skuteczna i bezpieczna dla pacjenta. Ostatnie innowacje, które doprowadziły do wprowadzenia szczepionek mRNA przeciwko COVID-19, w znacznej mierze udoskonaliły stabilność mRNA, efektywność dostarczenia do komórek oraz produkcję białek antygenowych. Obecnie na etapie badań klinicznych znajduje się wiele preparatów celujących w różne rodzaje nowotworów, takich jak czerniak, rak płuc czy prostaty, a kolejne są już w planach.
Paradoksalnie pandemia, która zabiera życie tysiącom ludzi dziennie, może stać się szansą na rozwój nowoczesnych terapii przeciwko innym niebezpiecznym chorobom. ©
Korzystałam z: Siddhartha Mukherjee „Gen. Ukryta historia”, Czarne 2017.
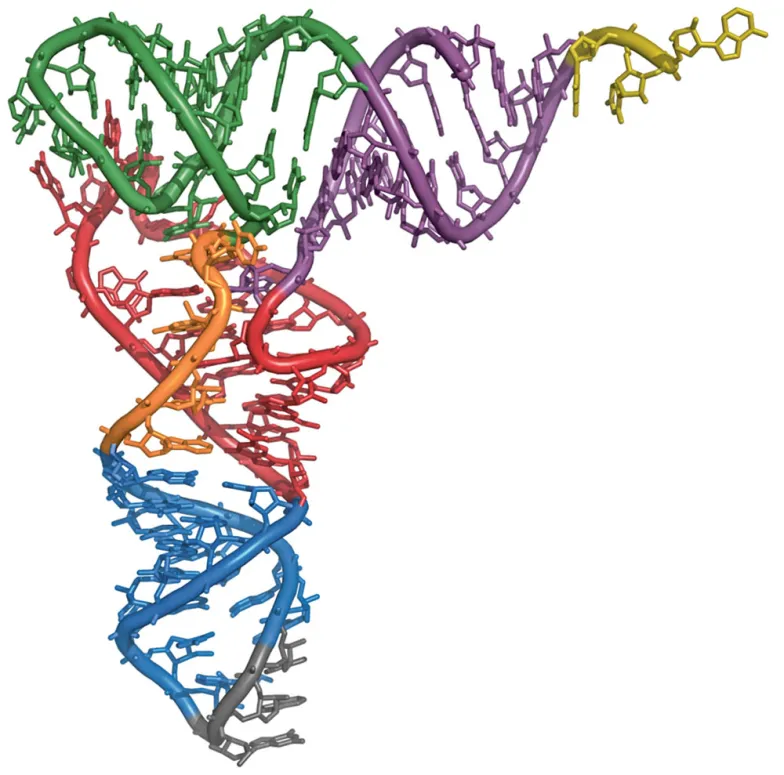
ŚWIAT RNA
WSZYSTKIE ORGANIZMY żywe – od bakterii po szympansa – posiadają informację genetyczną przechowywaną w postaci DNA, dzielą również część tych samych genów. To jeden z najważniejszych dowodów na poprawność teorii ewolucji, która głosi, że wszystkie organizmy pochodzą od wspólnego przodka, i wyjaśnia, w jaki sposób dobór naturalny doprowadził do powstania tak wielu form żywych, jakie obserwujemy na Ziemi – wliczając w to nas samych.
EWOLUCJA DROGĄ DOBORU naturalnego co do zasady może zachodzić nawet w przyrodzie nieożywionej, ale wymaga specyficznych warunków: m.in. istnienia replikatorów, czyli cząstek, które są zdolne do produkowania własnych kopii (dzięki pozyskiwanym w otoczeniu zasobom). Jeśli te kopie nie będą idealnie dokładne, a pojawiające się w ten sposób różnice będą wpływać na skuteczność dalszego kopiowania się replikatorów, to dobór naturalny zacznie już działać. W kolejnych „pokoleniach” pojawią się replikatory coraz sprawniej generujące własne kopie (coraz lepiej „dostosowane”). W tym sensie ewolucja mogła poprzedzać powstanie życia, jakie znamy – i utorować mu drogę (w którymś momencie replikatory „ożyły” – ich maszyneria chemiczna tak bardzo się rozrosła, że pojawił się w nich metabolizm czy procesy samoregulujące).
PROBLEM W TYM, że nie wiemy, jak mogły wyglądać te pierwotne replikatory. Znane nam formy życia, nawet najprostsze, są chemicznie bardzo złożone, w dodatku występuje w nich kłopotliwy dualizm: fenotypu i genotypu. Organizmy funkcjonują dzięki białkom, ale same białka nie potrafią się replikować. Potrzebują do tego przepisu – informacji genetycznej. Ta trwale jest przechowywana w DNA, ale DNA pozostawione samo sobie też nie potrafi się kopiować ani nawet produkować białek. Co innego RNA – ono też jest nośnikiem informacji genetycznej, bierze udział w syntezie białek, potrafi się kopiować i przyspieszać różne reakcje chemiczne.
DLATEGO już w latach 60. XX w. pojawiła się hipoteza, zgodnie z którą to właśnie cząstki RNA były pierwszymi replikatorami na Ziemi, ok. 4 mld lat temu. W dalszym toku ewolucji „replikatory RNA” stworzyły białka, a także „wynalazły” bardziej trwały sposób przechowywania informacji genetycznej – w DNA. Być może śladem po tym starodawnym „świecie RNA” są te wirusy, które informację genetyczną zapisują wyłącznie w RNA. © (P) ŁK