Wykupienie dostępu pozwoli Ci czytać artykuły wysokiej jakości i wspierać niezależne dziennikarstwo w wymagających dla wydawców czasach. Rośnij z nami! Pełna oferta →
Organizacja Narodów Zjednoczonych w grudniu 2017 r. specjalnym dekretem ustanowiła rok 2019 rokiem układu okresowego pierwiastków. Jak podano w wyjaśnieniu: „Narody Zjednoczone chcą pokazać znaczenie chemii w promowaniu zrównoważonego rozwoju i w rozwiązywaniu wyzwań m.in. w dziedzinie energii, rolnictwa, zdrowia i innych ważnych sektorach”.
Nie rozwiążemy problemów nękających świat bez chemii, a ona znajduje się w tablicy okresowości. Wybór bieżącego roku nie jest przypadkowy, gdyż właśnie mija 150 lat od publikacji pierwszej wersji układu przez Dmitrija Mendelejewa, najważniejszego z jego sześciu odkrywców.
Układ okresowy wyraża prawo okresowości – niezmienne i uniwersalne prawo przyrody. Odkryli go chemicy, ale jego wyjaśnienie należało do fizyków. Prawo to głosi, że chemiczne i fizyczne właściwości pierwiastków zmieniają się w systematyczny i przewidywalny sposób, gdy te są ułożone według wzrastającej liczby atomowej. Jak wiadomo, liczba atomowa (porządkowa) to liczba protonów zawartych w jądrze atomowym, równa liczbie elektronów tworzących powłoki wokół jądra. Gdyby ułożyć pierwiastki w szereg według wzrostu ich liczby porządkowej, wtedy co pewien ściśle określony interwał spotka się pierwiastek o podobnych właściwościach.
Kamień z Rosetty
Okresowość właściwości fizycznych i chemicznych wyrażająca fundamentalną zależność pomiędzy pierwiastkami (czyli prawo przyrody) można tak przedstawić, żeby pierwiastki podobne znajdowały się w jednej kolumnie. Podobieństwo to wynika z identycznych konfiguracji elektronowych ich powłoki zewnętrznej, czyli najdalszej od jądra. Reakcje chemiczne zachodzą z udziałem jedynie elektronów tej powłoki – a całą chemię można określić jako naukę o mechanizmach zmian w powłokach walencyjnych atomów. W przypadku prawa okresowości niezwykłe jest to, że wiersze tablicy mają różną długość (2, 8, 18 i 32). Prawo można przedstawić przy użyciu różnych form graficznych. Istnieje już ponad tysiąc postaci układu okresowego.
Występujące w układzie okresowym 118 pierwiastków tworzy ok. 15 mln związków organicznych, 1,5 mln związków nieorganicznych i drugie tyle związków metaloorganicznych. Według astronoma Harlowa Shapleya jest on „najbardziej zwartą i znaczącą kompilacją wiedzy, którą posiadł człowiek”.
Klimatolog Rudy Baum nazwał układ okresowy „kamieniem z Rosetty przyrody”. Jak wiadomo, kamień z Rosetty, zabytek piśmiennictwa z II wieku przed Chrystusem, zawiera inskrypcję hieroglificzną. Znajomość języka koptyjskiego pomogła Jeanowi-François Champollionowi w jej odczytaniu. Podobnie układ okresowy jest narzędziem do zrozumienia świata materii.
Historyk Robert Hicks określił tablicę układu jako „najbardziej rozpoznawalną ikonę wszystkich nauk”. Tak jak w ikonie patrzący widzi coś więcej aniżeli obraz, w tablicy może zobaczyć nie tylko 118 kwadratów ułożonych w rzędy i kolumny, ale wiedzę o świecie materialnym.
Chaos i harmonia
W okresie przednaukowym chemii, czyli do ok. XVII w., wysiłki alchemików skupione były głównie na poszukiwaniu kamienia filozoficznego, który miał zmieniać metale nieszlachetne w złoto. To udało się osiągnąć dopiero w XX w. poprzez bombardowanie atomów rtęci neutronami. Chociaż alchemicy często byli szalbierzami, to niepodważalnym ich osiągnięciem stały się przypadkowe odkrycia nowych pierwiastków. Na przykład 350 lat temu Hennig Brand odkrył fosfor, ważny pierwiastek w biologii. Z czasów alchemii pochodzi także nasz sprzęt laboratoryjny: kolbki, chłodnice, łaźnie.
Narodziny chemii jako nauki miały miejsce w XVIII w., wraz z odkryciem praw chemicznych, m.in. prawa zachowania masy (Antoine Lavoisier w 1789 r.). Dokonano tego poprzez ważenie i mierzenie substancji używanych w reakcjach, czyli „matematyzację” chemii.
W latach 60. XIX w. znano 62 pierwiastki i metodę precyzyjnego wyznaczania mas atomowych, co doprowadziło do odkrycia prawa okresowości. Ten okres rozwoju chemii pokazuje, że wszystko ma swój czas. Gdyby znano mniej pierwiastków, nie zauważono by występujących prawidłowości. Gdyby było ich więcej – nie znaleziono by dla nich miejsca w tablicy.
Sześciu odkrywców
Ludzie, którym zawdzięczamy układ okresowy, pracowali w różnych miejscach świata i nie kontaktowali się wzajemnie. Pierwszym z nich był francuski geolog Alexandre Béguyer de Chancourtois. Zauważył, że pierwiastki ułożone w formie spirali według wzrastającej masy atomowej tworzą układ, w którym co ósmy wykazuje podobieństwo we właściwościach do pierwiastka leżącego powyżej i poniżej. Niestety, jego publikacja z winy redaktorów czasopisma naukowego ukazała się bez rysunku – kluczowego elementu.
Kolejnym odkrywcą był angielski producent cukru i nauczyciel chemii John Newlands. Podobieństwo pierwszego i ósmego pierwiastka skojarzył z oktawą muzyczną. Jednak nie mógł sobie poradzić z kolejnymi pierwiastkami i porzucił badania. Do tego przyczynił się również odbiór jego wykładu na forum Londyńskiego Towarzystwa Chemicznego, na którym wyśmiano go pytaniem: „A może należałoby ułożyć pierwiastki w kolejności alfabetycznej?”.
Inny Anglik, William Olding, na konferencji w Karlsruhe w 1860 r. przedstawił potrzebę ujednolicenia sposobu wyznaczania mas atomowych pierwiastków. Był to czas niemałego bałaganu: znano wtedy aż 16 wzorów kwasu octowego! Metodę taką zaproponował włoski chemik Stanislao Cannizzaro. Korzystając z niej w 1864 r. Olding opublikował tablicę, zachowując puste miejsca m.in. dla pierwiastka występującego po glinie (gal), a także po krzemie (german). Jednak nie przykładał znaczenia do tego odkrycia.
Najbardziej ekstrawagancki w podejściu do problemu klasyfikacji pierwiastków był Gustavus Hinrichs, Duńczyk pracujący w Stanach Zjednoczonych. Ułożenie pierwiastków oparł na modelu koła, którego szprychy stanowiły dzisiejsze grupy układu.
Najważniejszym obok Mendelejewa odkrywcą układu okresowego był Niemiec Lothar Meyer, privatdozent (utrzymujący się z czesnego studentów) na Uniwersytecie Wrocławskim, a następnie od 1866 r. profesor Szkoły Leśnej w Neustadt-Eberswalde. W 1868 r. Meyer opracował tablicę niewiele różniącą się od tej, którą pokazał później Mendelejew. Wprowadził ją do wydanego (niestety) dopiero po 27 latach podręcznika chemii. Podkreśleniem wkładu Meyera i Mendelejewa w odkrycie układu okresowego był otrzymany wspólnie w 1882 r. medal Davy’ego, przyznawany przez Londyńskie Towarzystwo Królewskie za ważne osiągnięcia w chemii.
Sen deisty
Dmitrij Mendelejew (urodzony w 1834 r. w Tobolsku na Syberii) był najmłodszym z być może nawet siedemnaściorga dzieci Marii i Iwana Mendelejewów. Wychowany w wierze prawosławnej (dziadek był popem) w późniejszych latach przeszedł na deizm – pogląd o istnieniu Boga, który nie ingeruje w stworzony świat. Po śmierci ojca, wraz matką i jedną z sióstr udał się do oddalonej o 2400 km Moskwy, by kontynuować edukację. Niestety, na Uniwersytecie nie przyjmowano kandydatów spoza miasta. Cała trójka wyjechała więc do Petersburga (kolejne 700 km). Ale i tu studia były tylko dla mieszkańców miasta. Dmitrij został studentem Szkoły Pedagogicznej tylko dzięki protekcji kolegi ojca. Po studiach wyjechał do Heidelbergu, do laboratorium Roberta Bunsena. Dużo podróżował po Europie, nawiązując kontakty naukowe. Po powrocie do kraju obronił doktorat i został zatrudniony na Uniwersytecie Petersburskim, gdzie zajmował się głównie poszukiwaniem relacji występujących między pierwiastkami.
Czytaj także: MIrosław Dworniczak: Człowiek, który uporządkował chemię
Legenda głosi, że układ okresowy przyśnił się Mendelejewowi. Obudzony wykrzyknął: „Myślę, że już to wiem, myślę, że już to rozumiem!”. Sam zainteresowany twierdził, że zanim go „zobaczył”, wiele lat o nim myślał. Pierwsza publikacja układu ukazała się w czasopiśmie Rosyjskiego Towarzystwa Fizyko-Chemicznego (1869). W tym samym roku opublikował abstrakt w „Berichte der Deutschen Chemischen Gesellschaft”.
Pierwiastek abstrakcyjny
Układ Mendelejewa jest niewątpliwie najdojrzalszym spośród sześciu propozycji. Jego głębokie zrozumienie oparte było na arystotelesowskim pojęciu pierwiastka abstrakcyjnego. Mendelejew twierdził, że układ okresowy dotyczy pierwiastków abstrakcyjnych, których materialnym śladem jest masa atomowa. To pozwoliło mu zmieniać położenie znanych pierwiastków i zostawiać miejsca dla nieznanych z dokładnym określeniem ich właściwości. Wiedział, że odkrył prawo przyrody.
Miejsc dla nieznanych pierwiastków znalazł 18, z tego 9 okazało się prawdziwymi. Na liście pomyłek są m.in. nieistniejące, lżejsze od wodoru pierwiastki eter i koron. Trafne przewidywania uczyniły go sławnym. Na przykład w roku 1875 Paul Lecoq de Boisbaudran odkrył pierwiastek nazwany na cześć Francji galem. Mendelejew przewidując sześć lat wcześniej właściwości galu, podał jego prawidłowy ciężar właściwy i odkrywca musiał skorygować swój wynik! Ponadto Mendelejew poprawił wyliczenia mas atomowych i zmienił położenie kilku znanych pierwiastków.
Tablica układu okresowego przeżyła wiele rewolucyjnych wstrząsów. Nie obaliły jej odkrycia gazów szlachetnych (lata 90. XIX w.), „podzielności” atomu oraz izotopów (początek XX w.). Nawet mechanika kwantowa nie podważyła jej znaczenia. To wszystko świadczy o sile układu.
Odkrycie prawa przyrody predestynowało Mendelejewa do Nagrody Nobla. Jego kandydatura była przedstawiana w latach 1905 i 1906 (Mendelejew zmarł w 1907 r.). Jak się wydaje, zadecydowały jednak kwestie osobiste. Mendelejew niezbyt entuzjastycznie odnosił się do teorii dysocjacji elektrolitycznej, za którą w 1903 r. szwedzki fizykochemik Svante Arrhenius otrzymał Nagrodę Nobla. W odwecie wpływowy Arrhenius nie popierał kandydatury Mendelejewa – i ta poległa m.in. w rywalizacji z Henrim Moissanem, odkrywcą fluoru i pieca elektrycznego.
Do góry nogami
Rok układu okresowego świętujemy, znając kompletnie zapełnioną tablicę. Układając pierwiastki od 1 do 118, widać powtarzalność właściwości chemicznych, która zachodzi w zmieniających się długością, ale regularnych okresach: 2, 8, 8, 18, 18, 32, 32. Istnienie wielu form graficznych świadczy o ogromnej sile inspirującej prawa okresowości. Na przykład brytyjski chemik Martyn Poliakoff wraz ze współpracownikami zaproponowali odwróconą tablicę. W ich opinii jest ona bardziej naturalna. Większość właściwości, jak masa atomowa, reaktywność, wzrasta od dołu do góry. Co więcej, skoro lżejsze pierwiastki są na dole, rozbudowa powłok elektronowych w atomie jest łatwiejsza do zrozumienia, gdyż zapełniane są powłoki od leżącej najbliżej jądra. Ktoś zauważył: „Wreszcie układ okresowy posiada nogi!”.
Inną ciekawą formą układu jest spirala. Przewaga kształtu spirali leży w fakcie, że inaczej niż w tablicy nie ma „przeskoków” pomiędzy ostatnim pierwiastkiem danego okresu a pierwszym następnego.
Wśród tablic konwencjonalnych wyróżnia się trzy zasadnicze formy: krótką, średnio-długą i długą. Tablica krótka ma znaczenie historyczne. Najpopularniejsza z nich jest średnio-długa: 18 kolumn (grup), 7 wierszy (okresów) oraz dwa szeregi lantanowców i aktynowców, posiadająca formę łatwą do ekspozycji. W tablicy długiej pierwiastki ułożone są nieprzerwanie od 1 do 118 według rosnącej liczby porządkowej.
Zastanawiające jest, że mimo 150 lat od odkrycia prawa okresowości wciąż poszukiwana jest jego optymalna forma graficzna. Nie wiemy, czy wodór posiadając jeden proton w jądrze powinien leżeć w grupie 1 (metali alkalicznych), czy w grupie 17 (fluorowców), gdyż tak jak tym ostatnim brakuje mu jednego elektronu do posiadania zamkniętej powłoki. Czy hel (dwa protony w jądrze) jest pierwiastkiem ziem alkalicznych (grupa 2), czy gazem szlachetnym (grupa 18)? To pytanie o to, co jest ważniejsze: konfiguracja elektronowa (fizyka) czy właściwości chemiczne?
Lantan i aktyn oraz lutet i lorens to kandydaci do grupy trzeciej. W 2015 r. Międzynarodowa Unia Chemii Czystej i Stosowanej (ang. IUPAC) powołała zespół ekspertów ds. składu tej grupy, ale brak jest jak dotąd jednomyślności w wyborze: czy po skandzie i itrze powinny znaleźć się lantan i aktyn, czy lutet i lorens. O ile liczba atomowa jako podstawa położenia pierwiastka w tablicy nie budzi wątpliwości, o tyle w niektórych przypadkach konfiguracja elektronowa (fizyka) i właściwości (chemia) nie zawsze są zgodne.
Wobec przeciągającej się dyskusji w zespole, wśród badaczy zaczyna dominować opinia, że nie należy szukać jednej formy graficznej układu, a raczej modeli dla określonych potrzeb. Ktoś porównał dyskusję nad położeniem pierwiastków do rzeźby, na którą pod różnymi kątami pada światło, czego efektem są wielokształtne cienie. Tablica układu (nie prawo przyrody) to konstrukcja ludzka – z konieczności niedoskonała.
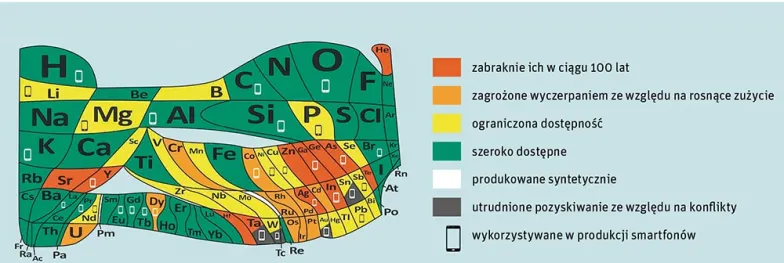
Znikające zasoby
Wydaje się jednak, że poza tymi problemami, które pewnie kiedyś będą rozwiązane, przed nami stoi ważniejsze zadanie: ochrona Ziemi. Wyrazem tego jest nowa tablica pokazana w Paryżu na ceremonii otwarcia roku układu, ilustrująca zasoby geologiczne i tempo ich zużywania.
Chociaż układ okresowy odzwierciedla porządek natury, to stał się częścią zarówno kultury wysokiej, jak i popkultury. Ubrania, breloczki, meble, ściany domów czy samochody ozdobione tablicą Mendelejewa nie są już rzadkim widokiem.
Powstało też wiele wierszy, piosenek i powieści o pierwiastkach. Ponadto, jeśli cokolwiek można skategoryzować (zespoły muzyczne, alkohole, owoce etc.), często przyjmuje to kształt tablicy układu okresowego.
Zapamiętajmy tablicę pokazaną w tym roku w Paryżu. Od 150 lat szukamy najwłaściwszej formy prezentacji prawa okresowości pierwiastków – to chyba ona pokazuje to, co w tej chwili najważniejsze. ©
Autorka jest emerytowanym profesorem Wydziału Chemicznego Politechniki Wrocławskiej.
Korzystałam z książek: E.R. Scerri „Układ okresowy. Historia i znaczenie”, (Oficyna Wydawnicza Politechniki Wrocławskiej 2013); E. Scerri, G. Restrepo „Mendeleev to Oganesson” (Oxford University Press 2018).








